2型糖尿病(T2DM)、非酒精性脂肪肝病(NAFLD)等代谢性疾病,已成为我国重大公共卫生问题之一。然而,其病理生理机制,仍有待进一步明确。过往的研究表明,遗传易感性、营养摄入不均衡、缺乏锻炼可能在这类疾病的发生发展中起着关键作用。然而,近年来的人群和动物研究则证实:隔代(Transgeneration)或跨代(Intergeneration)遗传在代谢性疾病中亦扮演着重要作用。即:父亲或母亲面临的环境因素(营养摄入、吸烟、药物史等),通过生殖细胞介导的表观遗传机制(DNA甲基化、小RNA等),遗传至子代的代谢性器官(肝脏、胰岛等),调控糖脂代谢途径重要基因的表达,从而影响器官的功能,导致糖脂代谢紊乱的发生。值得注意的是,由于父亲的影响因素仅限于生殖细胞(精子),机制上更为单一、明了,近年来受到国际上的广泛关注。Cell Metabolism杂志于2015年举办创刊10周年纪念时,更是将该话题列为未来的十大挑战之一(Top 10 Challenges)。例如,模式动物的实验结果表明:给予父亲高脂、低蛋白、高糖等饮食处理后,其子代发生糖脂代谢紊乱的风险明显增加【1-4】;此外,与正常男性、减肥手术后男性相比,肥胖男性的精子中,与下丘脑功能尤其是食欲调节密切相关的基因,其启动子区域DNA甲基化、组蛋白修饰等存在显著异常【5】,从而在人群层面也佐证了跨代遗传对代谢性疾病的贡献。
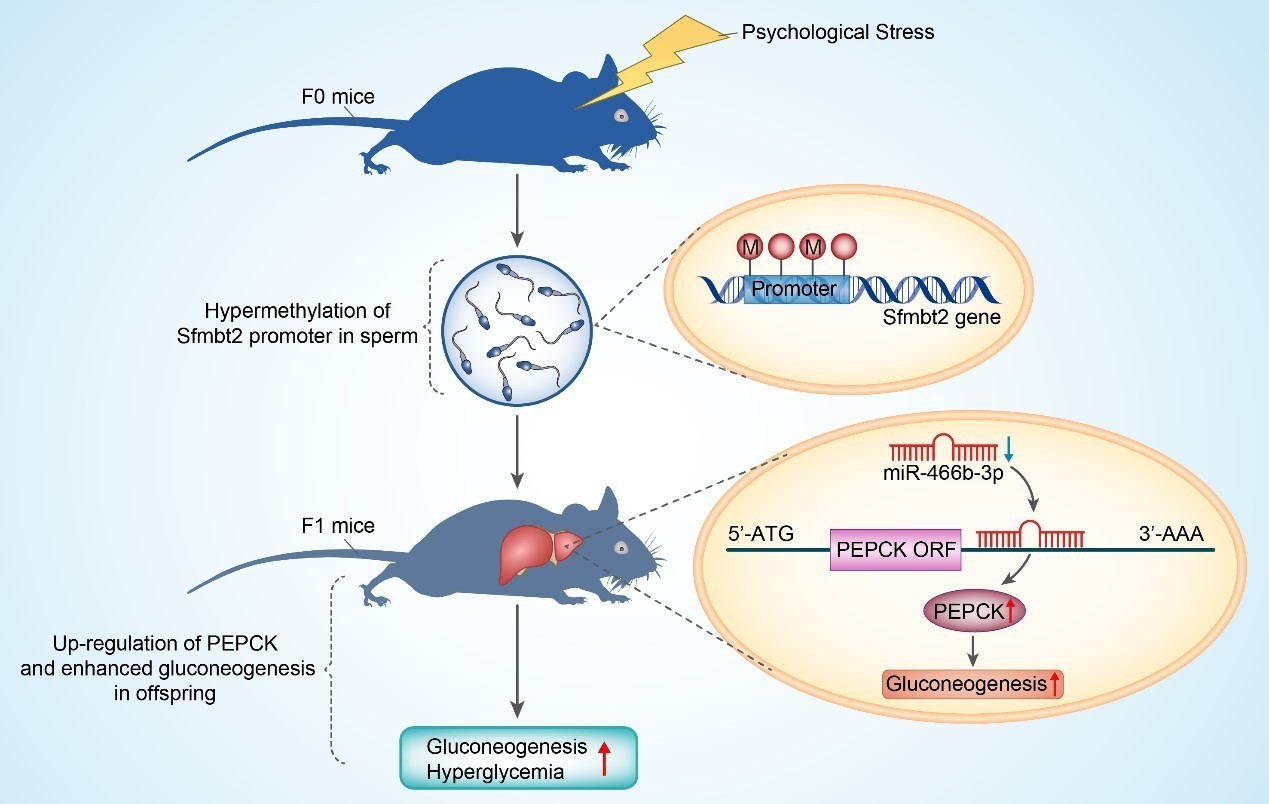
2016年4月,李小英教授带领团队,在Cell Metabolism杂志上发文,进一步阐述了该理论在代谢性疾病中的作用及相关机制【6】。当今社会,随着经济水平的发展,生活方式的转型,焦虑、紧张、抑郁等心理压力与应激日益频繁,已严重危害人类健康。大量人群流行病学研究表明,心理应激(Psychological stress)与多个疾病的发生发展密切相关,如神经退行性疾病、心血管疾病、肿瘤、2型糖尿病等。此外,近年来的研究表明,母亲的心理应激,尤其是妊娠期间的应激,可促进子代肥胖和2型糖尿病的发生。但父亲应激,能否影响或调控子代的糖代谢情况,目前尚无文献报道。鉴于此,李小英教授课题组以C57BL/6小鼠为动物模型,系统的探讨了这一跨代遗传现象及背后的分子机制。研究人员将8周龄雄性小鼠置于50毫升离心管中(Restraint stress),每天2小时,持续2周 (Stress组)。对照组小鼠 (Control组)在此期间,自由进食与活动。2周后,将两组小鼠分别与正常雌鼠交配,进而获得子代小鼠 (F1)。进而,课题组详细观察了两组小鼠(Control-F1、Stress-F1)的糖代谢表型,并发现:Stress-F1小鼠表现为血糖升高,丙酮酸耐量实验表明肝脏糖异生和肝糖输出能力增强,而葡萄糖和胰岛素耐量实验表明胰岛素敏感性并未改变。在基因表达层面,Stress-F1小鼠肝脏PEPCK的蛋白水平显著增加,但mRNA无明显改变,提示PEPCK的表达可能受到转录后水平的调节。由此,课题组通过MicroRNA表达谱芯片,筛选出调节PEPCK表达的一个MicroRNA: miRNA-466b-3p的表达在Stress-F1小鼠肝脏中显著下调。在此基础上,课题组发现父亲应激后,血清糖皮质激素水平显著升高,引起精子miRNA-466b-3p启动子区域甲基化程度的增加,并遗传至子代小鼠,导致其肝脏中miR-466b-3p的表达下调,引起PEPCK蛋白表达的增加,从而引发子代小鼠糖异生增加,血糖升高(见下示意图)。
因此,该研究首次发现,父亲的心理应激,通过表观遗传等机制,调控子代的糖代谢状况,从而进一步证实了环境因素介导的跨代遗传调控作用。而这些结果,不仅为日后人群层面相关疾病的研究提供有益的线索和理论基础,还有望建立代谢性疾病发病机制的新理论,从而为相关疾病的干预提供新的思路。
1.Ng SF, Lin RC, Laybutt DR, et al. Chronic high-fat diet in fathers programs β-cell dysfunction in female rat offspring. Nature. 2010; 467(7318):963-6.
2.Carone BR, Fauquier L, Habib N, et al. Paternally induced transgenerational environmental reprogramming of metabolic gene expression in mammals. Cell. 2010; 143(7):1084-96.
3.Öst A, Lempradl A, Casas E, et al. Paternal diet defines offspring chromatin state and intergenerational obesity. Cell. 2014; 159(6):1352-64.
4.Chen Q, Yan M, Cao Z, et al. Sperm tsRNAs contribute to intergenerational inheritance of an acquired metabolic disorder. Science. 2016; 351(6271):397-400.
5.Donkin I, Versteyhe S, Ingerslev LR, et al. Obesity and bariatric surgery drive epigenetic variation of spermatozoa in humans. Cell Metab. 2016; 23(2):369-78.
6.Wu L, Lu Y, Jiao Y, et al. Paternal psychological stress reprograms hepatic gluconeogenesis in offspring. Cell Metab. 2016; 23(4):735-43.
