文章来源:中华糖尿病杂志, 2021,13(3) : 270-272
作者:郭柯宇 伍西羽 肖扬 杨琳
单位:中南大学湘雅二医院代谢内分泌科 中南大学糖尿病免疫学教育部重点实验室 国家代谢性疾病临床医学研究中心
摘要
脂肪萎缩糖尿病是一类由于胰岛素作用的遗传缺陷所致的特殊类型糖尿病,本文中报道了一例脂肪萎缩糖尿病女性患者,于青春期以高血糖伴酮症、胰腺炎起病,起病时空腹C肽低,诊断为特发1型糖尿病后,进一步检查发现患者月经紊乱,全身体脂比例降低,部分脂肪萎缩以及皮肤黑棘皮样改变,辅助检查显示高血糖和高甘油三酯血症,肝功能异常,空腹与餐后C肽明显增高,重度脂肪肝及双侧卵巢多囊样改变。并且其父亲亦存在部分脂肪萎缩和高甘油三酯血症,经基因检测提示该患者及其父亲均存在LMNA Lys486Glu突变,由于该患者起病方式较为特殊,其脂肪萎缩范围较同型患者更广,且存在LAMN基因新的氨基酸改变,提示可能为家族性部分脂肪萎缩糖尿病2型这一新的亚型。
脂肪萎缩糖尿病(lipodystrophic diabetes,LD)是一类由于胰岛素作用的遗传缺陷所致的特殊类型糖尿病,根据脂肪丢失的部位分为全身性LD和局部性LD,根据发病机制的不同分为先天性LD和获得性LD[1]。LD是一种极其罕见的综合征,估计患病率为(1.3~4.7)/100万,家族性部分性LD(congenital familial partial LD,FPLD)患病率约为2.84/100万[2]。LD多于青春期起病,女性的临床表现较男性较易于察觉,其中先天局部性LD这一亚型中最常见的是FPLD,临床表现为不同程度的脂肪缺失,脂质代谢紊乱,严重的胰岛素抵抗所致的糖尿病。同时可伴有肝脾肿大,肾脏病变、性早熟、多毛、月经紊乱和多囊卵巢综合征等[3]。由于患者伴脂质代谢紊乱和胰岛素抵抗,临床容易被误诊为2型糖尿病,但目前尚未见该型起病方式类似1型糖尿病的报道。
患者女,15岁。因“发现血糖升高10个月”入院,患者2018年10月21日因进食含糖食物后感上腹部疼痛,伴口干、多饮、多食及体重下降,就诊于本地某省级医院。查空腹血糖19.00 mmol/L(参考值范围3.90~6.10 mmol/L),糖化血红蛋白15.1%(5.0%~8.0%),血β羟丁酸3 074.20 μmol/L(30~300 μmol/L),空腹C肽0. 746 ng/ml(参考值范围1.1~4.4 ng/ml),尿酮3+,尿糖3+,甘油三酯4.13 mmol/L(0.45~1.69 mmol/L),糖尿病自身抗体未见明显异常(外送当地第三方医学检验中心)。胸部加全腹部CT示胰腺炎,胰周及腹腔积液,肝脾增大,右侧附件区囊性灶。出院诊断“特发性1型糖尿病”,予“甘精胰岛素联合赖脯胰岛素”降糖,甘精胰岛素12 U睡前皮下注射,赖脯胰岛素早餐前-午餐前-晚餐前:3 U-6 U-3 U皮下注射,2019年5月改为“甘精胰岛素12 U、阿卡波糖50 mg tid及西格列汀100 mg qd”降糖,在家监测空腹血糖6.6~8.1 mmol/L,餐后血糖5.5~12.4 mmol/L。2019年8月22日患者就诊于我院1型糖尿病门诊,门诊以“糖尿病分型待定:LD?”收入院。既往史:2018年发现血脂异常,口服非诺贝特调脂,效果欠佳。个人史:第一胎第一产,出生体重3.35 kg,有腮腺炎病史。月经史:2018年8月初潮,2018年10月停经,口服黄体酮后2019年7月再次来潮,月经不规律。婚育史:未婚未育。家族史:父母非近亲结婚,家族中外婆患2型糖尿病,父亲颜面部和四肢脂肪萎缩,肌肉发达,2014年3月体检甘油三酯4.38 mmol/L。查体:身高169 cm,体重59 kg,体质指数20.7 kg/m2,颜面部、四肢和臀部皮下脂肪消失,四肢肌肉发达,双腋下、颈后可见黑棘皮样改变,头发浓密,发际线下移,四肢毳毛浓密。肝脏右肋缘下5 cm可触及,质韧,无压痛,脾未触及,双侧乳房发育,Tanner分期Ⅲ期,外阴Tanner分期Ⅲ期,有阴毛生长,大小阴唇肥厚。辅助检查:丙氨酸氨基转移酶66.3 U/L(7.0~40.0 U/L),天冬氨酸氨基转移酶57.2 U/L(13.0~35.0 U/L),谷氨酰氨基转肽酶120.3 U/L(7.0~45.0 U/L)。甘油三酯5.62 mmol/L(<1.71 mmol/L),高密度脂蛋白胆固醇0.73 mmol/L(>1.04 mmol/L),低密度脂蛋白胆固醇3.53 mmol/L(<3.12 mmol/L),高密度脂蛋白胆固醇/总胆固醇0.14(0.15~1.00)。0 min-60 min-120 min血糖:6.35、8.40、8.65 mmol/L。C肽释放实验:0 min-60 min-120 min:1 001.6、2 061.3、4 052.4 pmol/L,睾酮1.79 nmol/L(0.52~1.47 nmol/L),25-羟基维生素D 18 nmol/L(缺乏:<50 nmol/L;不足:50~75 nmol/L;足够:76~250 nmol/L)。心脏+腹部彩超:房间隔膨出瘤声像;脂肪肝(重度);胆囊区旁低回声区,考虑脂肪沉积不均;胰腺测值稍大,实质光点增粗;双肾测值大。经直肠子宫彩超:双侧卵巢多囊样改变。心电图、骨密度、眼底检查、四肢血管多普勒和感觉阈值未见明显异常。患者X线双能体成分检测显示,患者全身脂肪比例14.8%,低于正常;四肢脂肪比例均低于年龄匹配的第1百分位数;躯干脂肪比例15.3%,躯干脂肪百分比/肢体脂肪百分比1.33(高于年龄匹配第99百分位数),躯干脂肪含量/肢体脂肪含量1.34(高于年龄匹配第99百分位数);并且提示内脏脂肪沉积。患者染色体检查未见异常,芯片捕获高通量全外显子组检测发现患者LMNA基因突变位点为c.1456A>G(p.Lys486Glu),486密码子赖氨酸错义突变为谷氨酸,患者及其父母同时进行sanger测序验证基因突变,患者基因型为杂合型,变异来源为其同为杂合型的父亲,患者母亲LMNA基因未发生突变(图1)。治疗随访:入院后采用甘精胰岛素联合赖脯胰岛素治疗,血糖监测空腹5.9~7.4 mmol/L,餐前4.9~7.9 mmol/L,餐后4.9~7.9 mmol/L,睡前5.7~10.9 mmol/L。出院时嘱患者低盐低脂糖尿病饮食,适当运动,通过生活方式改善胰岛素抵抗。患者以空腹血糖升高为主,仅用重组甘精胰岛素每日睡前10 U皮下注射,因餐后血糖波动尚可,肝功能异常,故暂未加用其他降糖药,多烯磷脂酰胆碱胶囊口服改善脂肪肝,双环醇片口服降低转氨酶,继续使用贝特类降脂药物。2个月后于我院糖尿病专科门诊复诊,平时监测血糖约2~4次/d,空腹7.1~8.5 mmol/L,餐前4.2~9.1 mmol/L,睡前5.5~9.6 mmol/L。查血脂与肝功能有改善,回报基因检测结果后确诊为FPLD2,加用二甲双胍口服改善胰岛素抵抗。
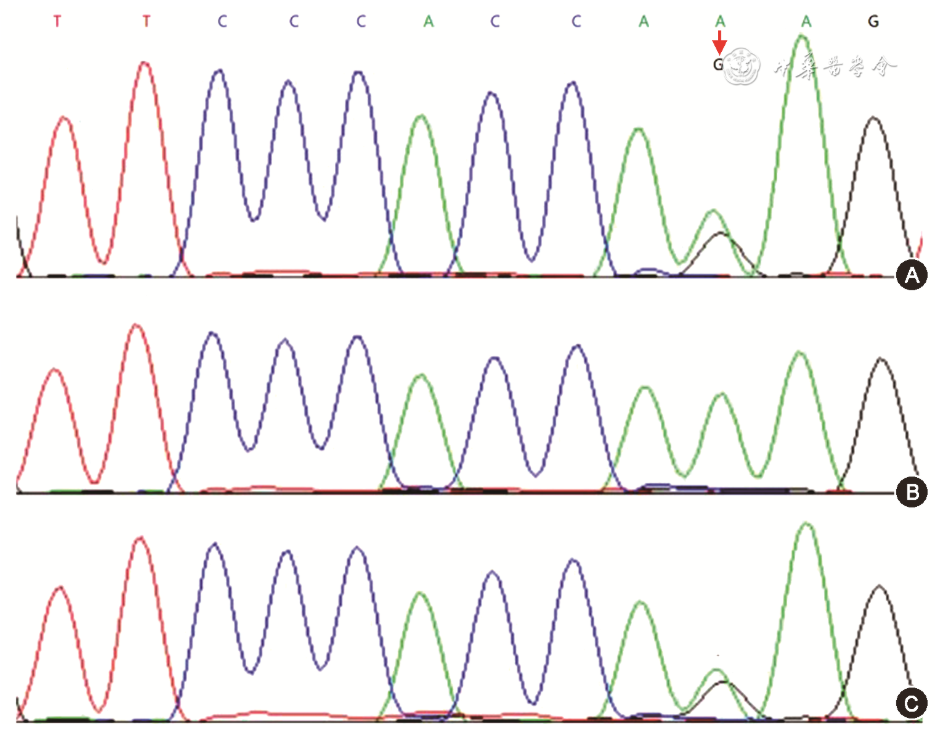
图1 患者及其父母的一代测序图。A~C分别为先证者父亲、先证者母亲及先证者的测序图。先证者及其父亲携带LMNA基因杂合突变,突变位点为c.1456A>G(p.Lys486Glu,红箭),母亲未携带该位点突变
讨论
本文中我们报道了一例酮症起病类似1型糖尿病的FPLD2,患者以特殊方式起病,相比已报道的FPDL2表现出更严重的脂质代谢紊乱与相对容易控制的糖代谢紊乱,基因变异位于已报道的突变1458G>T(K486N)同一位点,但患者的新的错义突变所导致氨基酸变化之前未曾报道,患者父亲为同一杂合型突变,父亲除局部脂肪萎缩及高甘油三酯外,至今未出现糖耐量异常。因此该患者可能是FPLD2型,也可能是新的突变所致的其他核纤层蛋白病与FPLD2共同作用下的早期表现,仍需进一步随访和探究。患者系青少年起病,起病时存在糖尿病症状,血糖和糖化血红蛋白明显升高以及C肽轻度降低,并伴有酮症,与1型糖尿病起病的特点类似,由于胰岛抗体阴性,故在外院被诊断为“特发性1型糖尿病”。患者起病时处于应激状态,在急性胰腺炎和严重高糖高脂毒性的多重因素作用下可能存在短暂的β细胞功能紊乱,导致胰岛素分泌相对减少,所以测得空腹C肽稍低,在严重的胰岛素抵抗背景下,作用于未完全萎缩的皮下脂肪,产生酮症,临床误诊为1型糖尿病。在胰腺炎和血糖明显控制后就诊于我院时发现C肽异常增高,提示存在明显的胰岛素抵抗。此外1型糖尿病所显示的消瘦往往表现为全身皮下脂肪减少与肌肉萎缩并存。而本例患者由于四肢皮下脂肪萎缩,四肢肌肉轮廓清晰,腓肠肌假性肥大。同时黑棘皮征出现以及停经的病史未引起患者及家属重视。本例患者的起病与1型糖尿病起病类似,但是详细的体格检查和综合分析可以发现LD的线索,通过进一步的实验室激素检查以及基因检测不难做出正确的诊断。
FPLD2具体发病机制目前尚不清楚,这类患者通常存在LMNA基因的突变。LAMN基因位于1p21,序列全长5.67 kb,编码区约24 kb包含12个外显子,编码的lamin A/C蛋白在DNA复制、核孔复合体的空间定位、及核稳定中发挥重要作用[4]。LMNA基因不同突变位点和lamin A/C蛋白的不同功能区突变可能引起特定部位特定类型细胞的凋亡,最终导致不同组织特异性的疾病[5, 6],统称为核纤层蛋白病。FPLD2的基因突变大多集中在LMNA第8外显子的482和486密码子上,其他外显子的突变也有报道[7, 8]。LMNA基因突变通过影响脂肪细胞分化、复制和成熟,引起四肢,躯干的脂肪细胞的凋亡最终表现为这些部位的脂肪萎缩,甚至影响并发症的发生发展[9]。
目前尚无FPLD2的特效治疗,只能针对糖脂代谢紊乱对症治疗。氧化物酶体增殖体活化受体γ(peroxisome proliferator-activated receptors γ,PPARγ)是脂肪分化的重要核转录因子,高表达于脂肪组织,但在FPLD2患者中PPARγ表达下降[10],噻唑烷二酮类药物激动PPARγ改善胰岛素抵抗,用于治疗FPLD2患者有较好的血糖控制效果[11, 12],对多囊卵巢综合征的治疗亦有好处。建议其在肝功能稳定后、签署知情同意书后可加用噻唑烷二酮类药物,但患者母亲担心肝损伤不良反应一直未同意使用。此外在FPLD2患者中存在脂联素和瘦素水平下降[13],目前美国食品药品监督管理局批准重组人瘦素类似物美罗西汀用于治疗全身LD患者[14]。
在FPLD2的诊断方面,特定部位的脂肪萎缩、高脂血症、严重的胰岛素抵抗、高雄激素血症及雄性化表现对诊断有重要的提示作用,但患者起病的临床表现和就诊时的主诉具有多样性[15],如本例患者因高脂血症诱发的急性胰腺炎初次就诊,此外女性也可能因严重胰岛素抵抗所致的多囊卵巢综合征、不孕症或继发性闭经就诊。因此要求临床医师具有整体思维,综合分析患者的临床表现与辅助检查结果,早期识别与诊断该病,必要时进行基因检测,以做出正确诊断,避免误诊和漏诊。
参考文献 略
来源:中华糖尿病杂志
